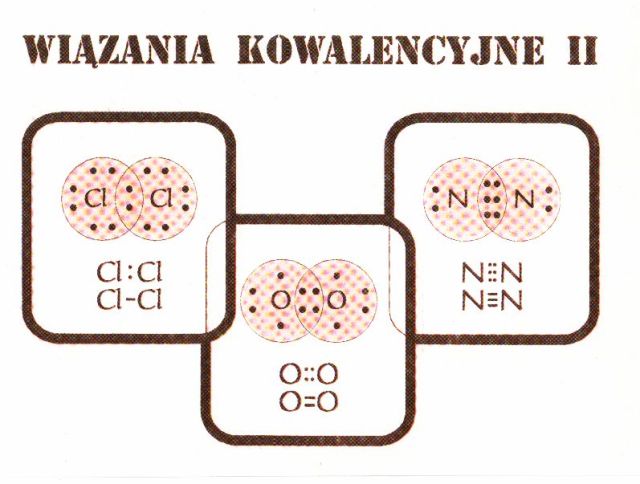
Wiązania kowalencyjne (plansza II)
W cząsteczce chloru utworzenie jednej wspólnej pary elektronowej przez dwa atomy chloru sprawia, że każdy z atomów chloru posiada na zewnętrznej powłoce elektronowej pełen oktet, a tym samym upodabnia się do zewnętrznej powłoki elektronowej neonu.
W dwuatomowej cząsteczce tlenu dwa atomy tlenu tworzą dwie wspólne pary elektronowe, a w dwuatomowej cząsteczce azotu atomy azotu tworzą trzy wspólne pary elektronowe i w ten sposób upodabniają swoje zewnętrzne powłoki elektronowe do zewnętrznej powłoki atomu neonu. Odpowiada to utworzeniu pojedynczego wiązania w dwuatomowej cząsteczce chloru, podwójnego wiązania w dwuatomowej cząsteczce tlenu i potrójnego wiązania w dwuatomowej cząsteczce azotu.
Pozostałe pary elektronowe oktetu elektronowego, które nie tworzą żadnych wiązań, nazywane są niewiążącymi (lub wolnymi) parami elektronowymi. W cząsteczce azotu każdy z atomów ma jedną wolną parę elektronową, a w cząsteczce tlenu każdy z atomów tlenu ma po dwie wolne pary elektronowe.
